MDR e IVDR: quante sono le richieste di notifica secondo questi due regolamenti?
Ad oggi, sono 34 Organismi Notificati secondo MDR. è l’Italia a guidare questa classifica, con ben 9 Organismi Notificati: IMQ, Istituto Superiore di Sanità, Italcert, Kiwa Cermet Italia, Eurofins, Certiquality, Ente Certificazione Macchine, Bureau Veritas Italia e TÜV Rheinland Italia.
Al secondo posto troviamo la Germania, che ne ha 8, e subito dopo i Paesi Bassi, che ne contano 3.
Ma qual è la situazione in termini di pipeline? Sembra essere una domanda interessante ed effettivamente lo è, tanto più ci si avvicina alle scadenze previste dalle leggi. La Commissione Europea ha fatto chiarezza pubblicando lo “State-of-play of joint assessments of Notified Bodies in the medical device sector”, che fotografa lo stato attuale delle richieste di notifica degli Organismi Notificati e delle loro valutazioni da parte delle Commissione in un documento estremamente sintetico che riassuma la situazione.
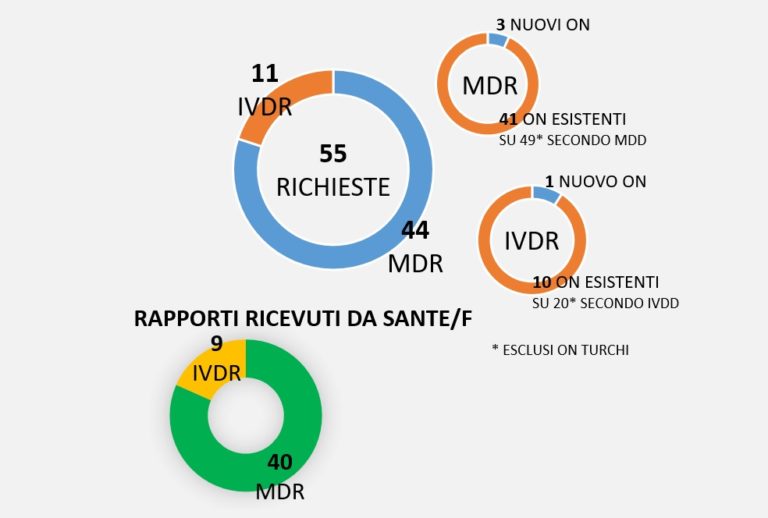
Su 55 richieste di notifica, 44 sono secondo MDR, mentre le restanti 11 sono secondo IVDR. La maggior parte degli enti che ha fatto richiesta secondo MDR erano (sono) ON secondo MDD, precisamente l’86%, ovvero 41 su 49, non contando gli enti di diritto turco. 3 sono i nuovi soggetti, di cui 1 si è ritirato.
Nel settore IVD, vediamo che 10 degli 11 “applicanti” sono ON sotto direttiva. Ciò vuol dire che ben 10 non hanno fatto richiesta e che, a meno di cambiamenti, il numero degli ON si dimezzerà per gli IVD.
Qui potete scaricare il documento di riepilogo edito a cura della Commissione Europea.