News & Stories
nuovo regolamento dispositivi medici in vitro
Il Medical Device Coordination Group ha pubblicato una nuova guida sull’applicazione del Regolamento (UE) 2017/746 sui dispositivi medico-diagnostici in vitro…
Dal 15 ottobre il mercato dei dispositivi diagnostici in vitro (IVD) può contare su un organismo notificato in meno: sospesa…
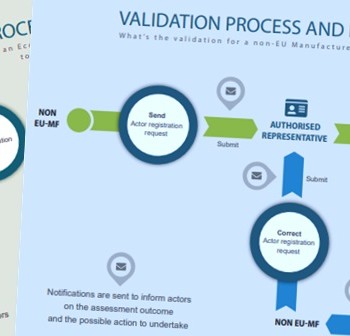
È stata pubblicata la nuova pagina web “Actor registration module” nella sezione del sito della Commissione Europea dedicata ad Eudamed
L’MHRA si sta preparando ad una BREXIT senza accordi. Scopriamo come e guardiamo alle principali criticità, a partire dallo status…
La Commissione Europea ha pubblicato l’aggiornamento del documento con le risposte alle domande più frequenti sull’UDI
Il Position Paper appena rilasciato è certamente un segnale incoraggiante che indica che l’implementazione graduale dei moduli Eudamed sta andando…
Lo scopo della scheda informativa pubblicata dalla Commissione Europea è di elencare le informazioni che saranno disponibili al pubblico in…
L’intento di questa nuova norma Norma ISO/TR 20416:2020 “Medical devices — Post-market surveillance for manufacturers” è quello di fornire indicazioni…