News & Stories
Affari regolatori
Lo scopo della scheda informativa pubblicata dalla Commissione Europea è di elencare le informazioni che saranno disponibili al pubblico in…
L’intento di questa nuova norma Norma ISO/TR 20416:2020 “Medical devices — Post-market surveillance for manufacturers” è quello di fornire indicazioni…
È stato pubblicato un documento che ha l’obiettivo di fornire informazioni sulle condizioni necessarie per immettere legalmente sul mercato dell’UE…
Equivalenza con dispositivi già esistenti. Dispositivi legacy; PMCF; immissione sul mercato di ventilatori polmonari per COVID-19 sono gli argomenti trattati.
Il Gruppo di coordinamento dei dispositivi medici dell’UE (MDCG) ha delineato il suo piano d’azione per rendere operativi i regolamenti…
Brexit, quanto tempo avranno le aziende per apportare le modifiche per garantire che i medicinali siano conformi al diritto UE…
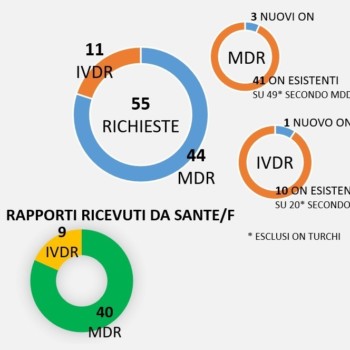
Pubblicato e disponibile un nuovo documento dalla Commissione Europea che fotografa lo stato attuale delle richieste di notifica degli Organismi…
Finalmente è stata pubblicata la nuova ISO 10993-18:2020 Biological evaluation of medical devices — Part 18: Chemical characterization of medical…