Nel panorama dei dispositivi medici e dei dispositivi medico-diagnostici in vitro (IVD), la conformità ai Regolamenti Europei è fondamentale per garantire la sicurezza e l’efficacia dei prodotti immessi sul mercato.
Un ruolo chiave in questo processo è svolto dagli Organismi Notificati (ON), enti designati per valutare e certificare la conformità dei dispositivi medici/IVD ai requisiti stabiliti.
Sapevi che ad oggi in Italia ci sono poco più di una decina di Organismi Notificati autorizzati per i dispositivi medici? E che non tutti coprono le stesse aree di competenza?
Ti aiutiamo a trovare quello perfetto per il tuo dispositivo.
Questo articolo esplora l’importanza degli ON secondo il Regolamento (UE) 2017/745 (MDR) e il Regolamento (UE) 2017/746 (IVDR), l’utilizzo del database NANDO per individuare gli ON italiani e un riassunto della loro mappatura aggiornata a maggio 2025.
L’importanza degli Organismi Notificati secondo i Regolamenti (UE) 2017/745 e 2017/746
I Regolamenti citati hanno introdotto requisiti più stringenti per la certificazione dei dispositivi medici/IVD nell’Unione Europea.
Per i dispositivi medici di classe I, l’MDR prevede che il fabbricante esegua una procedura di autocertificazione. Tuttavia, se tali dispositivi sono sterili, hanno funzione di misura o sono strumenti chirurgici riutilizzabili, è richiesto l’intervento di un Organismo Notificato per la valutazione della conformità che è tuttavia limitato ai seguenti punti:
- nel caso dei dispositivi immessi sul mercato sterili, agli aspetti relativi alla dimostrazione, al raggiungimento e al mantenimento dello stato sterile;
- nel caso dei dispositivi con funzione di misura, agli aspetti che riguardano la conformità dei dispositivi ai requisiti metrologici;
- nel caso di strumenti chirurgici riutilizzabili, agli aspetti relativi al riutilizzo del dispositivo, in particolare a pulizia, disinfezione, sterilizzazione, manutenzione, test funzionale e relative istruzioni per l’uso.
Questo assicura che anche i dispositivi a basso rischio siano sottoposti a controlli adeguati, quando necessario.
Nel caso degli IVD di classe A, se al momento dell’immissione sul mercato tali dispositivi sono sterili, è necessario l’intervento dell’ON, limitato agli aspetti relativi al conseguimento, alla preservazione e al mantenimento dello stato sterile.
Sei sicuro che il tuo dispositivo non abbia bisogno di un ON? Non è raro che molti dispositivi a basso rischio lo richiedano senza che il fabbricante se ne renda conto.
MDR – Comprendere i codici di designazione: MDA, MDN, MDS e MDT
Nel contesto della designazione MDR degli Organismi Notificati, i codici MDA, MDN, MDS e MDT giocano un ruolo cruciale nel definire le specifiche aree di competenza di ciascun ON.
Ecco una panoramica di questi codici che possono essere approfonditi nella linea guida MDCG 2019-14 “Explanatory note on MDR codes”:
- MDA (Medical Device Active): riguarda i dispositivi medici attivi, che dipendono da una fonte di energia per funzionare.
- MDN (Medical Device Non-active): si riferisce ai dispositivi medici non attivi, che non richiedono una fonte di energia per il loro funzionamento.
- MDS (Medical Device with specific characteristics): include dispositivi medici con caratteristiche specifiche e distintive, come quelli sterili o che incorporano medicinali.
- MDT (Medical Devices for which specific technologies or processes are used): copre le tecnologie specifiche utilizzate nei dispositivi medici, come le i materiali biotecnologici o l’utilizzo di clean room.
MDS e MDT riguardano competenze tecniche orizzontali degli ON.
Questi codici aiutano a identificare rapidamente le competenze specifiche di un Organismo Notificato, facilitando la scelta dell’ente più appropriato per la valutazione di un determinato dispositivo.
Un singolo dispositivo medico può rientrare in più categorie di classificazione, e quindi essere associato a diversi codici di designazione, in base alle sue caratteristiche tecniche, al suo utilizzo e ai requisiti di valutazione della conformità.
IVDR – Comprendere i codici di designazione: IVR, IVS, IVT, IVP e IVD
In relazione ai Dispositivi Medico-Diagnostici in vitro, i codici da considerare per le designazioni degli ON sono approfonditi nella linea guida MDCG 2021-14 “Explanatory note on IVDR codes” e di seguito riassunti:
- IVR (In Vitro Diagnostic Medical Device Rule): codice che riflette il design e lo scopo previsto del dispositivo.
- IVS (In Vitro Diagnostic Medical Device Specific Characteristics): codici orizzontali che descrivono le caratteristiche specifiche del dispositivo.
- IVT (In Vitro Diagnostic Medical Device Technologies): codici orizzontali a cui si riferiscono le tecnologie utilizzate.
- IVP (In Vitro Diagnostic Medical Device Examination Procedures): codici orizzontali che descrivono le conoscenze nelle procedure di esame.
- IVD (In Vitro Diagnostic Medical Device Laboratory and Clinical Disciplines): codici orizzontali che riflettono le conoscenze nelle discipline di laboratorio e cliniche.
L’IVR, in particolare, è un codice che la MDCG 2021-14 indica di assegnare singolarmente al dispositivo. Tuttavia, è possibile che più codici IVR siano applicabili ad un Dispositivo Medico-Diagnostici in vitro e, in questo caso, la MDCG 2021-14 indica di selezionare il primo riportato nell’ordine dato dal Regolamento (UE) 2017/2185 (approfondisci qui).
Un IVD può, invece, essere associato a più codici IVS, IVT, IVP e IVD (codici orizzontali) sulla base delle proprie caratteristiche.
Utilizzo del database NANDO per individuare gli Organismi Notificati italiani
Il database NANDO (New Approach Notified and Designated Organisations) è lo strumento ufficiale della Commissione Europea che elenca tutti gli Organismi Notificati designati per operare secondo le diverse direttive e regolamenti europei, incluso il MDR e l’IVDR.
Per individuare gli ON italiani nel settore dei dispositivi medici, è possibile seguire questi passaggi:
- Accesso al database NANDO: visitare il sito web della Commissione Europea dedicato agli Organismi Notificati.
- Ricerca per legislazione: utilizzare l’opzione di ricerca per paese e selezionare l’MDR (Regolamento (UE) 2017/745) o l’IVDR (Regolamento (UE) 2017/746) per visualizzare l’elenco di tutti gli ON designati.
- Filtro per paese: selezionare il filtro paese utilizzando l’opzione Italia per visualizzare la lista degli ON italiani designati
- Lista ON italiani a maggio 2025 per MDR: totale 11
- Lista ON italiani a maggio 2025 per IVDR: totale 2
4.Verifica delle competenze: cliccare su ciascun ON per ottenere dettagli sulle aree di competenza e sui codici di designazione associati incluse eventuali condizioni/esclusioni. Fare riferimento alla seguente immagine per un esempio:
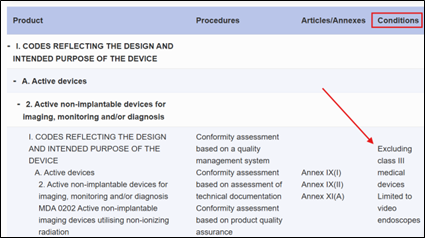
Fig. 1. Esempio di esclusione tratto dal sito: https://webgate.ec.europa.eu/single-market-compliance-space/notified-bodies/notifications/319592?organizationVersion=7
Questo processo permette ai fabbricanti e agli operatori del settore di identificare l’ON più adatto alle proprie esigenze, garantendo una collaborazione efficace per la certificazione dei dispositivi medici.
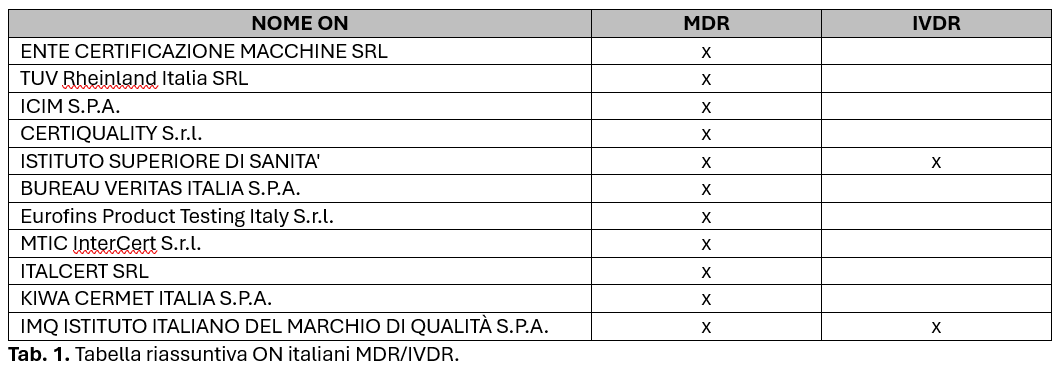
Considerazioni in merito alla varietà di codici di designazione MDR coperti dagli ON italiani
Analizzando le competenze degli ON riportate nel database NANDO fino a Maggio 2025 si nota una variabilità nelle aree di competenza coperte da ciascun ON.
Tutti gli ON riassunti in tabella 1 coprono in modo consistente la valutazione di dispositivi attivi, includendo quelli non impiantabili utilizzati per immagini, monitoraggio, diagnosi o scopi terapeutici (inclusi i software). Tuttavia, per ora solo IMQ ISTITUTO ITALIANO DEL MARCHIO DI QUALITÀ S.P.A. risulta designato per i dispositivi impiantabili attivi, e in particolare solo per i dispositivi impiantabili attivi per stimolazione/inibizione/monitoraggio (MDA 0101).
Allo stesso tempo, tutti gli ON trattano i dispositivi non attivi, come i dispositivi invasivi a lungo termine di tipo chirurgico o i dispositivi non impiantabili. Tra questi, l’ISTITUTO SUPERIORE DI SANITA’ è designato per tutti codici MDN dei dispositivi non attivi, senza esclusioni.
Inoltre, le competenze degli ON variano notevolmente anche per quanto riguarda i dispositivi con caratteristiche specifiche e distintive, come quelli sterili o che incorporano sostanze medicinali, e per le tecnologie o i processi specifici utilizzati nella loro fabbricazione, come i materiali biotecnologici o l’uso di camere bianche e ambienti controllati.
Alcuni ON possiedono una vasta gamma di queste competenze “orizzontali”, mentre altri sono più limitati. Questa diversità implica che un fabbricante deve accuratamente verificare se l’ON scelto ha la designazione necessaria per tutte le caratteristiche del proprio dispositivo. Un singolo dispositivo, infatti, può rientrare in più di queste categorie di classificazione, richiedendo quindi diverse aree di competenza da parte dell’ON.
Considerazioni in merito alla varietà di codici di designazione IVDR coperti dagli ON italiani
Il panorama degli Organismi Notificati italiani per l’IVDR è molto più limitato, con soli due ON attivi a maggio 2025. Sebbene entrambi gli ON mostrino una copertura estesa, si osservano comunque delle piccole differenze nelle loro designazioni.
Ad esempio, nelle competenze relative alla progettazione e allo scopo previsto del dispositivo, solo l’ISTITUTO SUPERIORE DI SANITA’ copre i dispositivi destinati a essere utilizzati nello screening/nella conferma di disfunzioni congenite/ereditarie (IVR 0401).
Conclusione
Con un numero limitato di Organismi Notificati e una domanda crescente, la selezione dell’ON giusto è un punto chiave per il successo e la sicurezza nel mercato dei dispositivi medici e IVD. Le differenze nelle loro competenze rendono la verifica approfondita sul database NANDO una mossa strategica per evitare ritardi significativi e garantire la conformità dei dispositivi. Per i fabbricanti, un’attenta scelta dell’ON italiano è un modo per navigare con prontezza l’iter registrativo e immettere sul mercato dispositivi sicuri ed efficaci.









