È stata pubblicata la nuova pagina web “Actor Registration Module” nella sezione del sito della Commissione Europea dedicata a Eudamed.
La nuova pagina conferma che la Commissione metterà a disposizione degli Stati membri e degli operatori economici il modulo di registrazione degli attori a partire dal 1° dicembre 2020 e rende accessibili diverse linee guida e infografiche.
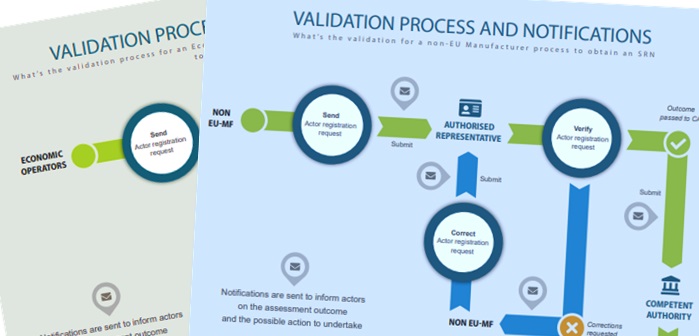
A partire dal 1° dicembre 2020, gli operatori economici che operano nel settore dei dispositivi medici (compresi i dispositivi medico-diagnostici in vitro – IVD) potranno richiedere un numero di registrazione unico già prima della data di applicazione dell’MDR (Regolamento UE 2017/745) e dell’IVDR (Regolamento UE 2017/746).
La Commissione Europea ha confermato la sua disponibilità a distribuire il modulo di registrazione degli attori del futuro database EUDAMED entro questo termine. Produttori, rappresentanti autorizzati, importatori e produttori di sistemi/procedure pack potranno scegliere di adempiere ai propri obblighi derivanti dal MDR/IVDR relativi alla registrazione a livello centrale o a livello nazionale. Le autorità nazionali competenti si sono impegnate ad accettare la registrazione effettuata tramite questo nella misura in cui la legislazione nazionale lo consenta. Ciò significa che si sono impegnate a evitare la doppia registrazione dello stesso attore per lo stesso ruolo, uno a livello nazionale e un altro in EUDAMED; ricordiamo che la registrazione è per ruolo, ad es. come rappresentante autorizzato e come importatore se un attore ricopre questi due ruoli separati.
Il vantaggio di ottenere un numero di registrazione unico in anticipo è quello di includerlo nella documentazione normativa pertinente (come la dichiarazione di conformità, la documentazione tecnica, i certificati emessi da un organismo notificato e il certificato di libera vendita) senza la necessità di aggiornarli in una fase successiva poiché l’SRN rimarrà stabile.