La proroga del MDR consente agli operatori economici di usufruire di un tempo maggiore per “mettersi in regola”, ma a precise condizioni. Abbiamo visto come anche nel caso più semplice, ovvero di certificati non scaduti al momento della pubblicazione del Regolamento di modifica, il fabbricante abbia comunque degli oneri che devono essere affrontati immediatamente; altre considerazioni, invece, potrebbero rendere opportuno che il fabbricante – pur avendo più tempo a disposizione – si attivi già con alcune azioni preliminari: le due date ultime per continuare a immettere in commercio i dispositivi, 31/12/2027 (Classe III e impiantabili di Classe IIb) e 31/12/2028 (Classe IIb diversi dai precedenti, Classe IIa o Classe I sterile o con funzione di misura) possono sembrare lontane nel tempo, ma si tenga presente che in quel momento si dovrà avere ottenuto la conformità al MDR per potere continuare a immettere in commercio. Oltre al tempo che dovrà essere impiegato per l’adeguamento del SGQ e della documentazione tecnica – per i quali sarà necessario comprendere quali siano le richieste espresse dal proprio ON per potere procedere nell’iter contrattualistico – si dovrà comunque considerare anche il tempo che l’ON poi dovrà impiegare per condurre la valutazione di conformità.
In sintesi, e premettendo che ogni caso deve essere valutato a sé, riteniamo di potere esprimere 10 punti e sottopunti, riguardanti il SGQ e il prodotto, su cui iniziare a concentrare la propria attenzione per non farsi trovare impreparati.
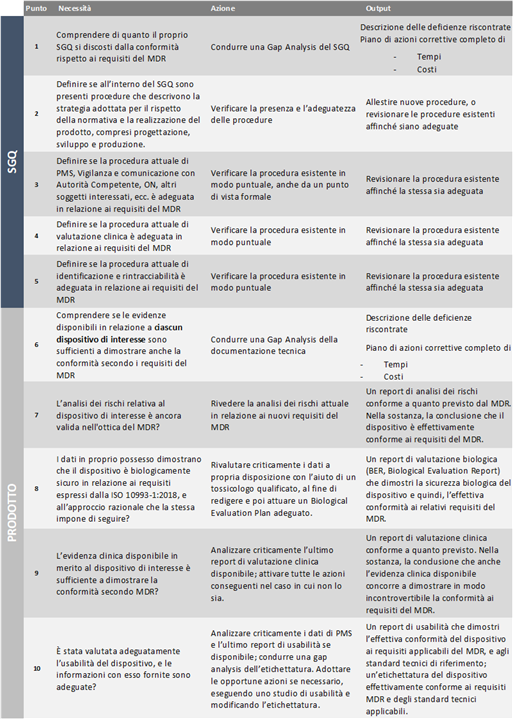
I punti elencati sono da ritenersi, come detto, esemplificativi e non esaustivi. È evidente, tuttavia, che – a prescindere dal caso particolare in esame e dallo specifico dispositivo di interesse – impongono che il fabbricante affronti fin d’ora e razionalmente il processo di adeguamento, al di là della latenza concessa dalla proroga, almeno considerando i punti 1 e 6, ovvero avere chiaro quali saranno i tempi e i costi di detto adeguamento.
Questo permetterà non solo di ottimizzare i tempi dell’adeguamento attraverso progetti organizzati correttamente nella sequenza delle azioni da compiere, ma anche di programmare investimenti lungo un arco temporale più ampio, ottimizzandone così la gestione economica e finanziaria.









