Tra i profondi cambiamenti conseguenti all’entrata in vigore del Regolamento (UE) 2017/745, c’è il rafforzamento dei requisiti sulle evidenze cliniche da produrre per l’ottenimento della marcatura CE, forse la sfida più grande da affrontare per i fabbricanti di dispositivi medici (DM).
Rispetto alla Direttiva 93/42/CEE sui dispositivi medici (MDD), il Regolamento pone maggior enfasi sui dati clinici e rafforza il controllo sull’obbligo dei fabbricanti di produrre, raccogliere, analizzare e valutare in maniera continuativa i dati clinici relativi a un dispositivo medico per verificarne la sicurezza (assenza di rischi clinici non accettabili), la prestazione clinica (capacità di ottenere la destinazione d’uso dichiarata dal fabbricante) e i benefici clinici (impatti positivi sulla salute di un individuo) quando il dispositivo è utilizzato come previsto dal fabbricante.
L’art. 2 lett. 48 stabilisce che i dati clinici sono “informazioni sulla sicurezza o sulle prestazioni ricavate dall’impiego di un dispositivo”.
In generale, la definizione e il tipo di “dati clinici” non sono cambiati in modo rilevante rispetto alla Direttiva, tuttavia il Regolamento rafforza la necessità che i dati clinici identificati e raccolti forniscano evidenze cliniche sufficienti, il cui livello deve essere “motivato” dal fabbricante e “appropriato” in considerazione delle caratteristiche del dispositivo e della sua destinazione d’uso.
Le evidenze cliniche – definite come dati e risultati clinici relativi a un dispositivo medico – devono essere di quantità e qualità sufficienti a consentire una valutazione qualificata della sicurezza e del raggiungimento dei benefici clinici attesi, e sono riconosciute come un elemento imprescindibile per dimostrare la conformità ai pertinenti requisiti generali di sicurezza e prestazione.
A questo punto, possono sorgere spontanee le due domande che seguono.
- Come precisare e motivare il livello di evidenze cliniche necessario (e appropriato) a dimostrare la conformità ai pertinenti requisiti generali di sicurezza e prestazione?
- Cosa si intende per evidenza clinica sufficiente?
Per rispondere, può venirci in aiuto il concetto di Evidence-based medicine (EBM, la medicina basata sull’evidenza) o Evidence-based practice (EBP, la pratica basata sulle evidenze), metodo scientifico che ha avuto una diffusione straordinaria nel corso degli anni ‘90 e prevede l’uso coscienzioso, esplicito e giudizioso delle migliori evidenze aggiornate, tenendo in considerazione la valutazione del medico e le esigenze del paziente.
L’approccio si basa su un modello a 5 fasi (i.e., definizione del quesito clinico rilevante, ricerca dell’evidenza migliore, valutazione della qualità dell’evidenza, azione sull’evidenza al fine di elaborare una decisione clinica, valutazione del processo) in parte analogo alle quattro fasi che caratterizzano il processo di valutazione clinica (Figura 1), ovvero:
- definizione del campo di applicazione (fase 0);
- identificazione dei dati pertinenti (fase 1);
- valutazione dei dati pertinenti (fase 2);
- analisi dei dati clinici (fase 3);
- report di valutazione clinica – inclusi i piani di PMS e di PMCF – (fase 4).
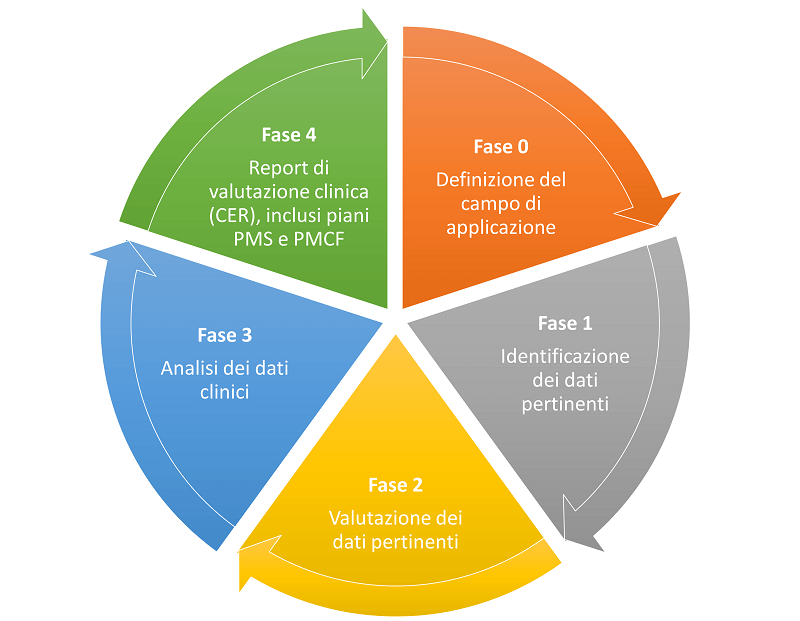
Figura 1 – Fasi di una valutazione clinica (riadattato da MEDDEV 2.7/1 rev.4)
Il livello di evidenza clinica rientra nel processo di valutazione della qualità dell’evidenza dell’EBP. Non tutti i dati clinici hanno lo stesso valore (o forza): le raccomandazioni di un esperto non sono solide quanto i risultati di uno studio ben condotto, che non sono altrettanto validi quanto i risultati di un insieme di studi ben condotti. Pertanto, nell’EBM i livelli di evidenza o i dati clinici devono essere classificati in base alla loro forza relativa, che prevede la gerarchizzazione delle fonti scientifiche dal più basso livello di evidenza al più elevato tenendo conto di grado di accuratezza, affidabilità, ridotti margini di errore e altri fattori statistici. La piramide nella figura sottostante mostra i vari livelli di evidenza e la rispettiva classificazione (Figura 2).
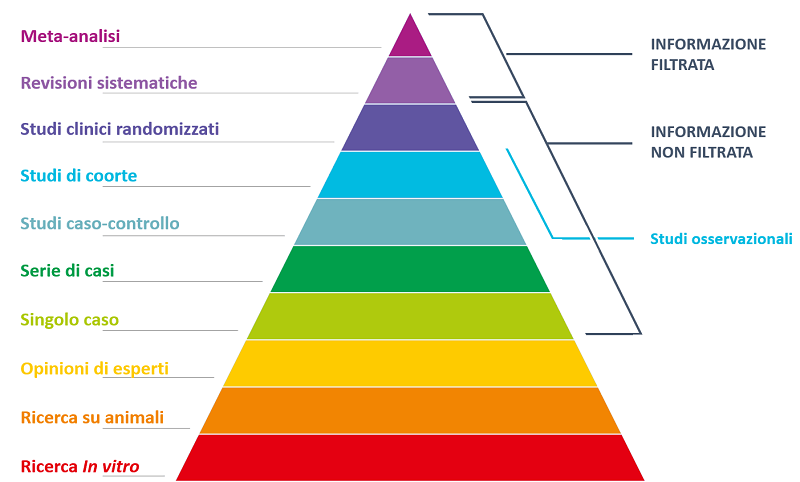
Figura 2 – Il modello della piramide: gerarchia delle fonti della medicina basata sulle evidenze.
Analogamente, nel processo di valutazione clinica, la fase di valutazione dei dati pertinenti (fase 2) è finalizzata a determinare, in modo sistematico e utilizzando strumenti di valutazione verificati/convalidati, i punti di forza e i limiti di uno studio clinico, nonché la sua idoneità a rispondere alle domande sul dispositivo e il suo contributo alla dimostrazione della sicurezza e delle prestazioni del dispositivo (compresi eventuali claim specifici).
Pertanto, il livello di evidenza è specificamente correlato alla qualità metodologica e alla validità scientifica dello studio, nonché alla tipologia dello studio stesso. La “quantità” delle evidenze cliniche dipende invece dalla tipologia dei risultati ottenuti (quantitativi o qualitativi) e da quanto possono considerarsi generalizzabili conclusioni tratte.
Sulla base di questi elementi, possiamo quindi concludere che il livello sufficiente di evidenza clinica è il risultato di una valutazione qualificata dei dati clinici, la quale indica che il dispositivo è sicuro e raggiunge i benefici previsti sulla base della qualità metodologica e della validità scientifica, nonché della quantità delle evidenze cliniche.







