La norma ISO 14155 è una norma internazionale elaborata dalla International Organization for Standardization (ISO), una federazione mondiale di enti di normalizzazione nazionali.
Formalmente, essendo uno standard tecnico, la ISO 14155 ha carattere volontario, e non esiste alcun obbligo legale di rispettarla. Tuttavia, allo stato attuale, essa costituisce il documento più autorevole a cui far riferimento per garantire che le indagini cliniche dei dispositivi medici siano condotte in modo etico, sicuro e scientificamente valido.
Ecco perché è auspicabile che tutti i dati derivanti da indagini cliniche inclusi nella documentazione tecnica di un dispositivo siano raccolti e trattati in conformità alla ISO 14155.
Gli obiettivi della ISO 14155
Come riportato nella parte introduttiva della norma, la ISO 14155 tratta la progettazione, l’esecuzione, la registrazione e la dimostrazione delle indagini cliniche condotte su soggetti umani per valutare la prestazione clinica o l’efficacia e la sicurezza di dispositivi medici a fini regolamentari.
Essa specifica i requisiti generali destinati a:
- tutelare i diritti, la sicurezza e il benessere dei soggetti umani (in linea con la dichiarazione di Helsinki);
- assicurare la condotta scientifica dell’indagine clinica e la credibilità dei suoi risultati;
- definire le responsabilità del promotore e dello sperimentatore principale;
- assistere i promotori, gli sperimentatori e le altre parti coinvolte nell’organizzazione, nell’esecuzione e nella valutazione delle indagini cliniche dei dispositivi medici.
I contenuti principali della ISO 14155
All’interno della ISO 14155 sono presenti varie sezioni, tra cui quelle dedicate a:
- Considerazioni etiche
Copre aspetti come la comunicazione col Comitato Etico, l’eventuale coinvolgimento di popolazioni vulnerabili e il consenso informato dei soggetti.
- Pianificazione dell’indagine clinica
Dà indicazioni su come condurre la pre-analisi del rischio per i dispositivi medici oggetto di studio, spiega in che modo fornire la giustificazione per la progettazione dell’indagine clinica, riepiloga i documenti richiesti per la pianificazione di tale indagine (piano di indagine clinica, dossier per lo sperimentatore, moduli di rapporto dei casi), affronta i temi della gestione del monitoraggio, della selezione dei siti di ricerca e degli accordi tra le parti coinvolte.
- Conduzione dell’indagine clinica
Fornisce linee guida e requisiti relativi all’inizio dell’indagine, al monitoraggio, alla gestione di eventi avversi e deficienze dei dispositivi, alla riservatezza dei dati, alla registrazione dei dispositivi sperimentali, al controllo dei dati e documenti, alla responsabilità dell’indagine e all’auditing.
- Sospensione, interruzione e chiusura dell’indagine clinica
Dettaglia procedure e requisiti per determinare quando un’indagine clinica è completa e quando può essere sospesa o terminata prematuramente, illustra com’è possibile riprendere un’indagine clinica dopo una sospensione temporanea, indica le attività di chiusura di routine e sottolinea l’importanza della compilazione del rapporto di indagine clinica e del mantenimento della documentazione relativa all’indagine.
- Responsabilità del promotore
Oltre ad esplicitare le responsabilità del promotore, fornisce linee guida e requisiti sulle procedure di gestione della qualità clinica da seguire durante lo svolgimento delle indagini cliniche.
- Responsabilità dello sperimentatore principale
Chiarisce il ruolo e le responsabilità dello sperimentatore principale nell’ambito dell’indagine clinica.
Nella parte finale della norma, sono presenti delle utilissime appendici che forniscono dettagli pratici e operativi su specifiche tematiche:
- Piano di indagine clinica (CIP);
- Dossier per lo sperimentatore (IB);
- Moduli di rapporto dei casi (CRF);
- Rapporto di indagine clinica (CIR);
- Documenti essenziali dell’indagine clinica;
- Categorizzazione degli eventi avversi.
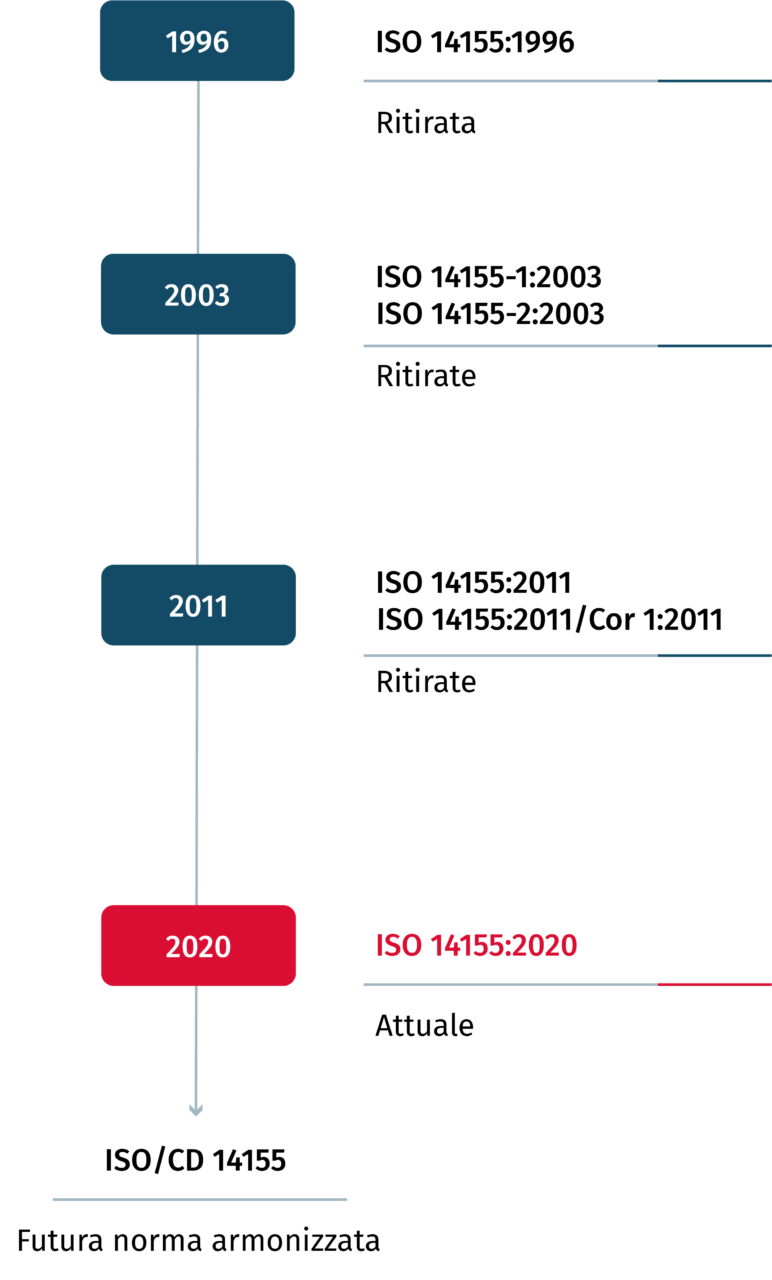
L’attuale versione della ISO 14155
Nel luglio 2020 è stata pubblicata la ISO 14155:2020, intitolata “Clinical investigation of medical devices for human subjects – Good clinical practice” (tr. Indagine clinica dei dispositivi medici per soggetti umani – Buona pratica clinica). Questa edizione sostituisce la versione del 2011 e si prevede sarà presto armonizzata per fornire uno standard di riferimento atto a sostenere le disposizioni dell’MDR relative alle indagini cliniche.