Uno studio di non inferiorità è un tipo di disegno sperimentale utilizzato per dimostrare che un nuovo trattamento non è peggiore di un trattamento standard esistente. In altre parole, questi studi non mirano a dimostrare che il nuovo trattamento sia superiore, bensì che non sia significativamente inferiore rispetto a quello standard, entro un margine predefinito.
Gli studi di non inferiorità vengono condotti quando vi è interesse a introdurre un nuovo trattamento che potrebbe offrire vantaggi diversi dall’efficacia clinica, ad esempio in termini di sicurezza (con minori effetti collaterali), convenienza economica (costi ridotti per pazienti o sistema sanitario) o comodità –somministrazioni meno frequenti o modalità di assunzione più semplici. In questi casi, la non inferiorità diventa un obiettivo clinico importante perché permette di proporre nuove terapie che, pur avendo un’efficacia simile, migliorano la qualità della vita o riducono il carico sanitario sotto altri aspetti.
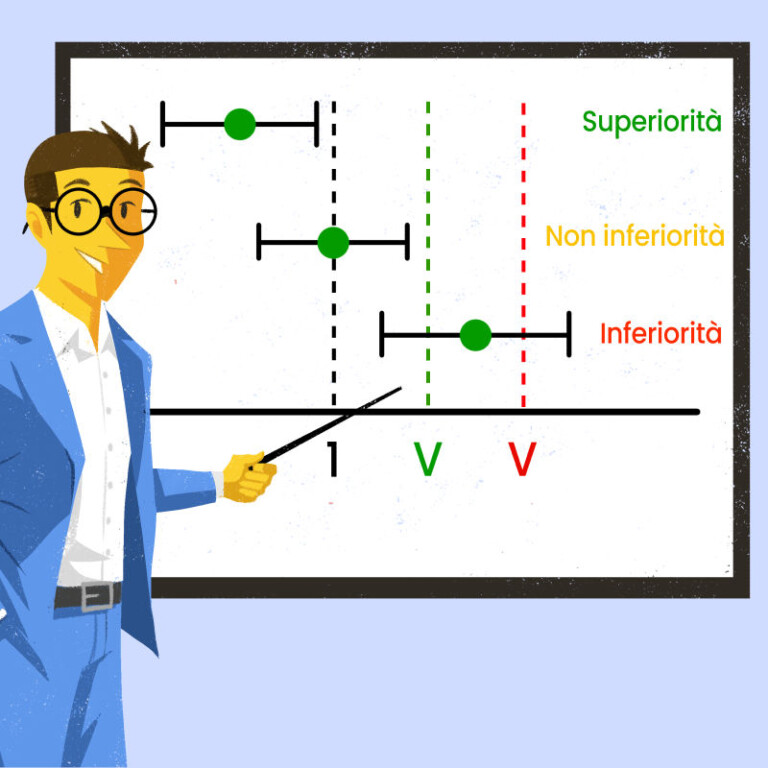
Per comprendere appieno il significato degli studi di non inferiorità, è utile confrontarli con altri due tipi di disegni di studio: quello di superiorità e di equivalenza.
Lo studio di superiorità ha l’obiettivo di dimostrare che un nuovo trattamento sia significativamente più efficace rispetto al trattamento di confronto. Quindi, i test statistici saranno mirati a trovare una differenza positiva tra i gruppi. Lo studio di equivalenza, invece, ha l’obiettivo di dimostrare che il nuovo trattamento è equivalente a quello standard, cioè che le differenze tra i due trattamenti rientrano entro un intervallo specificato.
Diversamente da questi due approcci, lo studio di non inferiorità mira a dimostrare che il nuovo trattamento non è significativamente peggiore di quello standard, senza cercare necessariamente di provare la superiorità del nuovo trattamento. Se lo studio di non inferiorità dimostra che il nuovo trattamento ha efficacia simile (non inferiore) al trattamento standard, potrebbe essere preferito per una maggiore facilità di somministrazione.
Il margine di non inferiorità
Un aspetto cruciale negli studi di non inferiorità è la definizione del margine di non inferiorità (spesso indicato come Δ), che rappresenta la massima perdita di efficacia tollerabile affinché il nuovo trattamento possa ancora essere considerato “non inferiore” rispetto a quello standard. Determinare il margine di non inferiorità è complesso e richiede un’attenta valutazione basata su dati di studi precedenti, valutazioni cliniche e precisione statistica. Infatti, per definire il margine di non inferiorità è necessario valutare la differenza osservata in precedenti studi di superiorità per il trattamento standard rispetto al placebo, considerando anche che tale margine deve essere clinicamente rilevante. Inoltre, il margine deve tenere conto della variabilità dei dati e della capacità dello studio di rilevare differenze significative: un margine troppo ampio, infatti, potrebbe mascherare una perdita significativa di efficacia.
Diversamente dagli studi di superiorità, quelli di non inferiorità non utilizzano un gruppo placebo come controllo; tale caratteristica rende più difficile interpretare i risultati, in quanto potrebbe esserci un effetto “diluizione” dovuto all’uso di un confronto attivo con un trattamento già efficace. Se il trattamento standard utilizzato come confronto è di poco più efficace del placebo, il margine di non inferiorità potrebbe portare a concludere erroneamente che il nuovo trattamento sia valido, anche se la sua efficacia è molto bassa. Per ridurre questo rischio, gli studi di non inferiorità dovrebbero essere basati su trattamenti standard di comprovata efficacia, e il margine di non inferiorità dovrebbe essere attentamente calcolato per evitare di introdurre nuovi trattamenti che, in realtà, sono inferiori rispetto allo standard o al placebo.
In fase di interpretazione dei risultati di uno studio di non inferiorità, l’intervallo di confidenza gioca un ruolo chiave: se l’intervallo di confidenza del trattamento sperimentale per cui si testa la non inferiorità è interamente al di sopra del margine, si può concludere che il trattamento è “non inferiore”. Se l’intervallo di confidenza include il margine di non inferiorità, non si può escludere una perdita clinicamente significativa di efficacia.
Criticità
Nonostante i molti vantaggi, gli studi di non inferiorità includono alcune criticità, legate principalmente alla definizione del margine – che spesse volte è soggettiva e può variare tra gli studi, rendendo difficile confrontare i risultati – ai bias interpretativi dovuti all’assenza di un gruppo di controllo (che può mascherare una riduzione di efficacia clinicamente rilevante), e a errori metodologici commessi in ambito statistico (calcolo della potenza o nell’analisi dei dati).
Conclusioni
Gli studi di non inferiorità svolgono un ruolo cruciale nella valutazione di nuovi trattamenti in ambito clinico, soprattutto quando si cercano terapie che offrano vantaggi pratici senza compromettere l’efficacia. Tuttavia, gli studi di non inferiorità richiedono un’attenta pianificazione sperimentale e interpretazione dei risultati per evitare conclusioni fuorvianti. La definizione accurata del margine di non inferiorità e l’uso di trattamenti standard efficaci come confronto sono fondamentali per garantire che i risultati siano clinicamente rilevanti e utili nella pratica medica. Minimizzando gli errori legati a questi aspetti, gli studi di non inferiorità possono portare a importanti innovazioni terapeutiche, migliorando l’accesso a trattamenti più sicuri, economici e convenienti per i pazienti.
Per approfondire:
- Cuzick, J., & Sasieni, P. (2022). Interpreting the results of noninferiority trials—a review. British journal of cancer, 127(10), 1755-1759.
- Mauri, L., & D’Agostino Sr, R. B. (2017). Challenges in the design and interpretation of noninferiority trials. New England Journal of Medicine, 377(14), 1357-1367.