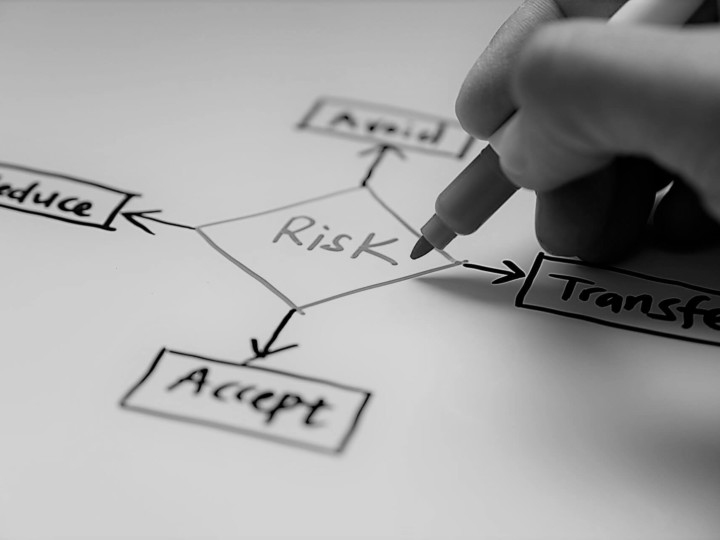
Compliance e accesso al mercato
Trasformiamo le sfide normative in una strategia volta a valorizzare i tuoi prodotti. Siamo al fianco dei clienti in ogni fase del ciclo regolatorio dei loro dispositivi, offrendo un ampio ventaglio di servizi progettati per garantire la conformità normativa in modo efficace e tempestivo.